【 戻る 】
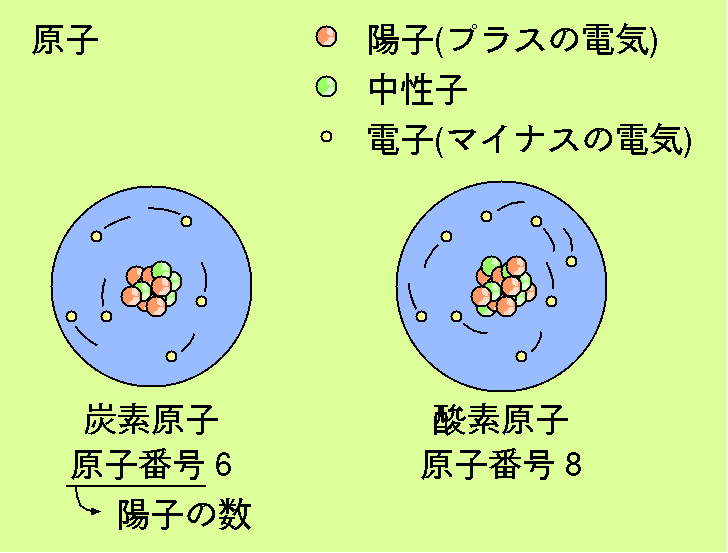
皆さんの身の回りにはたくさんの物質があふれていますが、 これらの物質はみな元素からできています。 酸素、炭素、そして窒素などの元素の名前を聞いたことがあると思います。 気体、液体、または固体などの状態が異なったり、 電気を通すものもあれば通さないものもあるなど、 それぞれに性質の異なる元素ですが、 これらの元素は全て原子という微粒子からできています。 原子は、 陽子と中性子が寄り集まってできた原子核の周りを 多数の電子が取り囲む形をしています。 陽子はプラスの電気、電子はマイナスの電気を持ち、 中性子は電気を持ちません。 一つの原子では プラスの電気とマイナスの電気が打ち消しあうように 陽子の個数と電子の個数が同じになっています。 陽子の数が6個のものは炭素、 陽子の数が8個のものは酸素という具合に 陽子の数の違いが元素の違いとして現れ、 特に陽子の数は原子番号と呼ばれています。

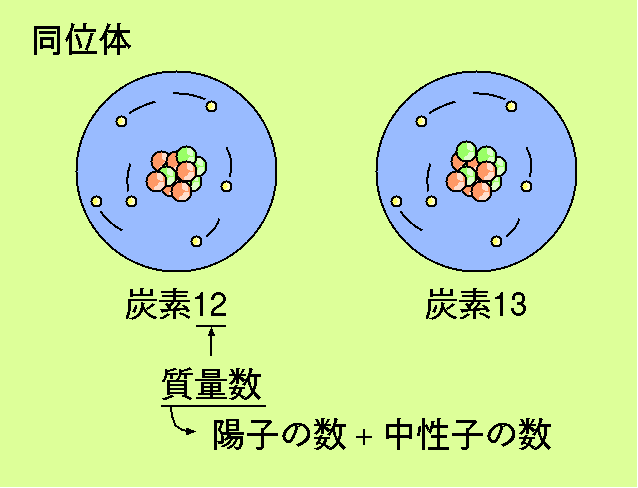
それでは中性子の数はどのように決まるのでしょうか? 一般的に陽子の数が決まると中性子の数が決まります。 陽子の数が少ない原子核はほぼ同数の中性子を持ち、 陽子の数が多い原子核は 陽子の数の約1.5倍の中性子を持ちます。 例えば 原子番号6の炭素は6個の中性子を持ち、 原子番号79の金は118個の中性子を持ちます。 このように書くと 原子番号が決まれば中性子の数が一通りに決まると思われるかも知れませんが、 実はそうではありません。 先程炭素は6個の中性子を持つと書きましたが、 中性子を7個持つ炭素もあります。 陽子の数と中性子の数を足し合わせたものを質量数と呼び、 この質量数を使ってこれらの二種類の炭素は 炭素12、炭素13と区別して呼ばれます。 地球上に存在する炭素の99%は炭素12で、 炭素13は残りのわずか1%にしか過ぎませんが、 この炭素13は中性子が1個多い分炭素12に比べて重くなっています。 このように同じ元素でも 中性子の数の違いによって重いものと軽いものがあり、 これらは同位体として区別されています。
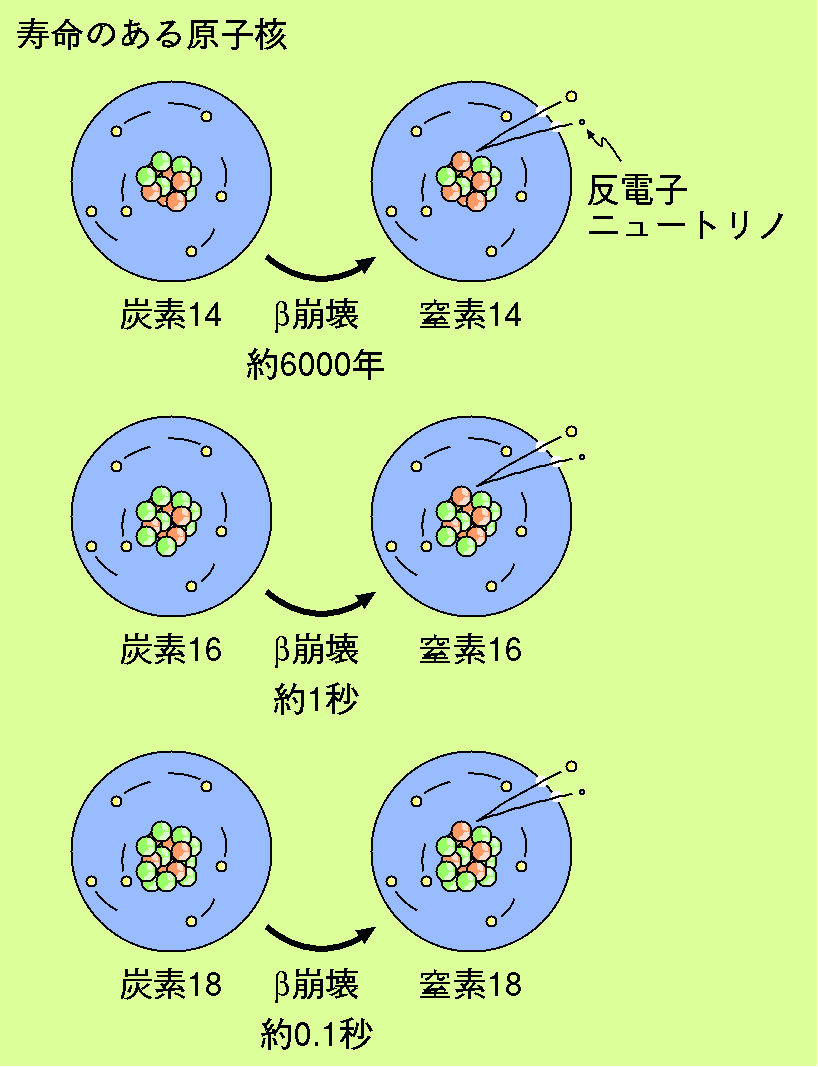
地球上に存在する炭素の同位体は炭素12と炭素13だけですが、 もっと中性子の数が多いものや少ないものはなぜ存在しないのでしょうか。 原子核には陽子の数と中性子の数のバランスで 安定に存在できるものとできないものがあります。 安定に存在できない原子核は崩壊して より安定な原子核に変わってしまいます。 例えば陽子を6個、中性子を8個持つ炭素14は 陽子を7個、中性子を7個持つ窒素14に変わります。 これをβ崩壊と呼びます。 これらの不安定な原子核にも 比較的安定なものと非常に不安定なものが存在します。 炭素14は崩壊するまでに平均で6000年ほどの時間が掛かりますが、 炭素16は1秒程度、炭素18は0.1秒程度で崩壊します。 このように数秒〜数ミリ秒で崩壊する不安定な原子核は 短寿命核と呼ばれます。
【 戻る 】